Свойства химической связиСтраница
3
3
H∙∙∙N энергия связи 10 кДж/моль
Водородная связь примерно в 10 раз слабее обычной ковалентной связи, но она оказывает очень большое влияние на физические и химические свойства соединений (например, аномально высокие темперетуры кипения и плавления)
Водородная связь вызывает ассоциацию молекул – образование димеров, тримеров и полимеров (димеры муравьиной и уксусной кислот, полимеры HF, воды)
Водородная связь имеет большое значение при растворении, т.к. растворимость зависит от возникновения водородных связей между молекулами или ионами растворённого вещества и растворителя. При этом образуются соответствующие соединения – сольваты (гидраты).
Слайд 17
Характеристики связи
Длина связи
Энергия связи
Направленность связи
Полярность связи
Слайд 18
Длина связи
Это расстояние между ядрами атомов в соединении
Слайд 19
Энергия связи
Это количество энергии, которое выделяется при образовании химической связи, кДж/моль.
Столько же энергии нужно затратить, чтобы разрушить химическую связь
Слайд 20
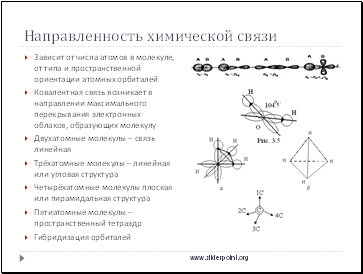
Направленность химической связи
Зависит от числа атомов в молекуле, от типа и пространственной ориентации атомных орбиталей
Ковалентная связь возникает в направлении максимального перекрывания электронных облаков, образующих молекулу
Двухатомные молекулы – связь линейная
Трёхатомные молекулы – линейная или угловая структура
Четырёхатомные молекулы плоская или пирамидальная структура
Пятиатомные молекулы – пространственный тетраэдр
Гибридизация орбиталей
Слайд 21
Полярность химической связи
Полярность связи определяется тем, какова электроотрицательность атомов, образующих связь
Полярность связи характеризуется величиной дипольного момента μ
C-H μ = 0,4
C-Cl μ = 2,05
H-F μ = 1,91
Na-I μ = 4,9
K-I μ = 6,8
Слайд 22
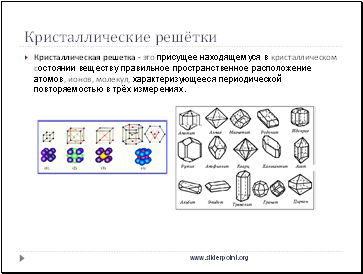
Кристаллические решётки
Кристаллическая решетка - это присущее находящемуся в кристаллическом состоянии веществу правильное пространственное расположение атомов, ионов, молекул, характеризующееся периодической повторяемостью в трёх измерениях.
Слайд 23
Ионная кристаллическая решётка
Обычно ионные кристаллы твердые, но хрупкие.
Ионные кристаллы отличаются высокими температурами плавления.
В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны.
Содержание
- Химическая связь
- Основные виды связей
- Правило октета
- Электроотрицательность
- Возбуждённое состояние атома
- Ионная химическая связь
- Ковалентная связь
- Металлическая связь
- Водородная связь
- Характеристики связи
- Длина связи
- Энергия связи
- Направленность химической связи
- Полярность химической связи
- Кристаллические решётки
- Ионная кристаллическая решётка
- Атомная кристаллическая решётка
- Молекулярная кристаллическая решётка
- Металлическая кристаллическая решётка
- Типы химической связи и их отличительные признаки
Последние добавления
- Интеграция различных подходов к менеджменту
- Что такое деньги
- Менеджмент
- Автобусы
- Агрегатное состояние
- Арктика
- Наука