Свойства химической связиСтраница
4
4
Растворяются в полярных растворителях (воде).
При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Слайд 24
Атомная кристаллическая решётка
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями (алмаз, графит).
Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Атомные кристаллы можно считать гигантскими молекулами.
Они очень прочные и твердые, плохо проводят теплоту и электричество.
Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах.
Практически нерастворимы в каких-либо растворителях.
Низкая реакционная способность.
Слайд 25
Молекулярная кристаллическая решётка
Молекулярные кристаллыпостроены из отдельных молекул, внутри которых атомы соединены ковалентными связями.
Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Кристалл льда (H₂O)
Кристалл СО₂ (сухой лёд)
Кристалл иода I₂
Слайд 26
Металлическая кристаллическая решётка
Характерна для металлов.
В ней имеется металлическая связь между атомами.
В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной.
Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
Слайд 27
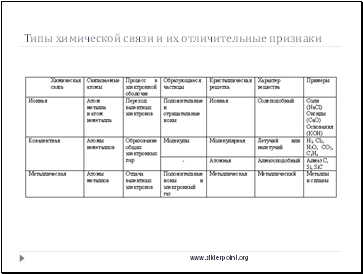
Типы химической связи и их отличительные признаки
Слайд 28
Содержание
- Химическая связь
- Основные виды связей
- Правило октета
- Электроотрицательность
- Возбуждённое состояние атома
- Ионная химическая связь
- Ковалентная связь
- Металлическая связь
- Водородная связь
- Характеристики связи
- Длина связи
- Энергия связи
- Направленность химической связи
- Полярность химической связи
- Кристаллические решётки
- Ионная кристаллическая решётка
- Атомная кристаллическая решётка
- Молекулярная кристаллическая решётка
- Металлическая кристаллическая решётка
- Типы химической связи и их отличительные признаки
Последние добавления
- Астрономия
- Психологическая уравновешенность человека
- Африка
- Модели Менеджмента
- Информационное управление
- Менеджмент в сестринском деле теория и практика
- Австралия